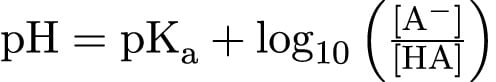ในทางเคมีคำจำกัดความของสารละลายบัฟเฟอร์คือสารละลายที่สามารถต้านทานการเปลี่ยนแปลง pH ได้จากการเติมกรดหรือเบส ประกอบด้วยสารละลายของกรดอ่อนและเบสคอนจูเกตหรือในทางกลับกัน
Buffer คือสารละลายที่มีประโยชน์อย่างยิ่งที่ใช้ในเคมี บางครั้งเมื่อสารละลายผสมกับกรดหรือเบสแก่ ค่า pH สามารถเปลี่ยนแปลงได้อย่างรวดเร็ว สารละลายบัฟเฟอร์ช่วยแก้กรดหรือเบสที่เติมเข้าไปบางส่วนเพื่อให้ pH ค่อยๆ เปลี่ยนแปลง
ซึ่งทำได้โดยประกอบด้วยส่วนประกอบที่จะทำปฏิกิริยากับไฮโดรเจนไอออน (กรด) หรือไฮดรอกไซด์ไอออน (เบส) เพื่อไม่ให้ส่งผลต่อ pH ที่ความจุสูงสุด
สารละลายบัฟเฟอร์มีข้อจำกัด ว่าสามารถต่อต้านได้มากเพียงใด เมื่อบัฟเฟอร์นี้ถึงความจุ สารละลายจะทำหน้าที่เสมือนว่าไม่มีบัฟเฟอร์อยู่ และ pH สามารถเริ่มเปลี่ยนแปลงอย่างรวดเร็วอีกครั้ง
หลักการของเลอชาเตอลิเยร์
ในปี พ.ศ. 2427 นักเคมีและวิศวกรชาวฝรั่งเศส เฮนรี-หลุยส์ เลอ ชาเตอลิเยร์ ได้เสนอแนวคิดหลักประการหนึ่งของสมดุลเคมี ซึ่งต่อมาเรียกว่าหลักการของเลอ ชาเตอลิเยร์ อธิบายสิ่งที่เกิดขึ้นกับระบบเมื่อมีบางสิ่งลบออกจากสมดุลชั่วคราว
วิธีหนึ่งในการทำเช่นนี้คือเปลี่ยนความเข้มข้นของส่วนประกอบหนึ่งของปฏิกิริยา pH เป็นการวัดผกผันของความเข้มข้นของไฮโดรเจนไอออนของสารละลาย
สารละลายที่มีความเข้มข้นสูงของไฮโดรเจนไอออนจะมีค่า pH ต่ำ และสารละลายที่มีความเข้มข้นของไอออน H+ ต่ำจะมีค่า pH สูง
สารละลายบัฟเฟอร์ต้องมีสารที่กำจัดไฮโดรเจนไอออนหรือไฮดรอกไซด์ไอออนที่เติมลงไป มิฉะนั้น pH ของสารละลายจะเปลี่ยนไป
เมื่อคุณสร้างสารละลายบัฟเฟอร์ที่เป็นกรด คุณจะเลื่อนตำแหน่งของสมดุลไปด้านใดด้านหนึ่ง เมื่อคุณสร้างสารละลายบัฟเฟอร์อัลคาไลน์ ตำแหน่งสมดุลจะเคลื่อนกลับไปอีกด้านหนึ่ง บัฟเฟอร์ทำงานโดยต่อต้านการเปลี่ยนแปลงและสร้างสมดุลใหม่
การทำสารละลายบัฟเฟอร์
ผสมกรดซิตริก 7.2 มล. กับโซเดียมซิเตรต 42.8 มล. เติมน้ำปราศจากไอออนให้เพียงพอเพื่อให้ปริมาตรรวมของส่วนผสมอยู่ที่ 100 มล. น้ำที่ใช้ในบัฟเฟอร์ควรบริสุทธิ์ที่สุด (น้ำปราศจากไอออนหรือกลั่น น้ำ DI) เพื่อรักษา pH ที่เป็นกลาง (กล่าวคือ เพื่อให้แน่ใจว่าน้ำไม่ส่งผลต่อระดับ pH)
ใช้เครื่องวัดค่า pH ที่มีความละเอียดอ่อนเพื่อปรับ pH และให้ได้ระดับที่คุณต้องการ สวมแว่นตานิรภัยและถุงมือตลอดเวลา แนะนำให้ใช้ผู้ใหญ่ดูแลสำหรับการทดลองทางวิทยาศาสตร์

สมการ Henderson Hasselbalch
เมื่อคุณสร้างบัฟเฟอร์โดยใช้กรดอ่อนและเบสคอนจูเกต บัฟเฟอร์จะคงค่า pH ของบัฟเฟอร์ไว้ และสามารถต้านทานการเปลี่ยนแปลงของ pH นั้นได้ หากเติมกรดหรือเบสเพิ่มเติมจำนวนเล็กน้อย
สมการ Henderson Hasselbalch แสดงด้านล่าง ใช้ pKa ของกรดอ่อนในการคำนวณว่าบัฟเฟอร์ pH คืออะไร เราจะไปดูตัวอย่างโดยละเอียดโดยใช้สมการนี้ในบทความแยกต่างหาก